Quando ci troviamo nello stato liquido, le particelle sono praticamente addossate le une alle altre, in quanto la loro energia cinetica non è in grado di vincere le forze di attrazione tra le molecole (forze intermolecolari) di conseguenza le distanze tra le molecole sono molto ridotte . In un liquido le forze intermolecolari non sono tanto elevate da trattenere le molecole le quali saranno in continuo movimento reciproco, come quelle di un aeriforme, ma, a differenza di quello che avviene in un gas, scorrono le une sulle altre senza separarsi . Per questa ragione i liquidi risultano fondamentalmente incomprimibili e presentano un volume proprio, ma tendono ad adattarsi alla forma del recipiente dove sono contenuti.
1. Diffusione
Il moto caotico delle particelle del liquido, così come avviene nei gas, determina il fenomeno della diffusione. Logicamente un liquido tenderà a diffondere più lentamente di un gas, dato che il movimento delle sue molecole viene ostacolato dalla presenza delle molecole vicine.

Si capisce che la diffusione non è altro che un movimento spontaneo delle particelle di un fluido da una zona dove sono più concentrate a una zona a minor concentrazione. La diffusione consente di raggiungere una condizione di equilibrio dinamico dove le differenze di concentrazione sono state annullate e tutto lo spazio occupabile dal fluido è occupato in modo omogeneo ed uniforme.
2. Evaporazione e tensione di vapore
Come abbiamo detto le particelle del fluido si muovono a una determinata velocità. Queste velocità (o le energie cinetiche) delle molecole possono essere descritte tramite una distribuzione di Maxwell. Ogni liquido presenta un valore critico di Energia cinetica (influenzato sia dalla natura chimica e dall’entità delle forze intermolecolari), oltre il quale le molecole possiedono una energia tale da permettere alle stesse molecole di abbandonare la superficie del liquido e passare allo stato di vapore.
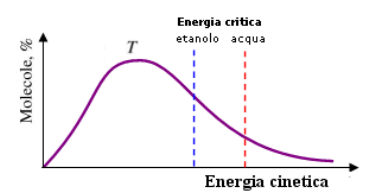
Questo processo coinvolge in linea generale solo le molecole sufficientemente energetiche localizzate sulla superficie del liquido ed è detto evaporazione. Se aumentiamo la temperatura del liquido la curva di Maxwell (la maxwelliana) tenderà a spostarsi verso destra e di conseguenza un numero maggiore di molecole acquisirà una energia cinetica sufficiente per passare allo stato di vapore. Più aumenta la temperatura più aumenterà il processo di evaporazione.

2.1 Evaporazione
Se mettiamo un liquido dentro un recipiente chiuso dove abbiamo precedentemente fatto il vuoto, lo spazio non occupato dal liquido verrà occupato dal suo vapore. Col passare del tempo il processo di evaporazione procede e il vapore che sovrasta la superficie del liquido si fa sempre più concentrato e la pressione che possiamo misurare all’interno del recipiente aumenta progressivamente.

2.2 Evaporazione > Condensazione
All’aumentare della concentrazione del vapore si fanno sempre più frequenti gli urti tra le particelle gassose da una parte e tra le particelle e le pareti del recipiente dall’altra, in modo tale che un numero sempre maggiore di molecole, trasferendo quantità di moto durante gli urti, perde energia cinetica e ricade sulla superficie del liquido. Il processo è noto come condensazione.

La velocità di condensazione aumenta dunque con l’aumentare della concentrazione del vapore.
![]()
La velocità di evaporazione è invece costante e dipende essenzialmente dalla temperatura e dalle forze intermolecolari. Per evaporare le molecole devono superare una Energia di soglia E che permetta loro di vincere le forze intermolecolari
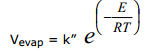
2.3 Evaporazione = Condensazione
Finché la velocità di evaporazione rimane più elevata di quella di condensazione, la concentrazione del vapore aumenta e, con essa, la pressione misurata. Si arriva tuttavia ad uno stato di equilibrio dinamico in cui la velocità del processo di evaporazione eguaglia la velocità del processo di condensazione. Poiché in tale situazione possiamo ritenere che il numero di particelle che evaporano sia pari al numero di particelle che condensano, il vapore non è in grado di arricchirsi ulteriormente e la pressione cessa dunque di aumentare. Il vapore viene per questo detto vapore saturo e la pressione esercitata è detta tensione di vapor saturo.

All’equilibrio avremo dunque
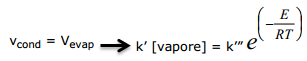
Visto che la pressione risulta direttamente proporzionale alla concentrazione del vapore si può anche scrivere in questo modo:
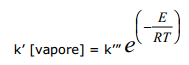
Questa equazione, analoga all’equazione di Clausius-Clapeyron, ci mostra come la tensione di vapore saturo aumenti in modo esponenziale con l’aumentare della temperatura.
3. Ebollizione
Come abbiamo già visto la tensione di vapore aumenta con la temperatura, poiché maggiore è il numero delle particelle che possiede un’energia cinetica superiore al valore critico. La tensione di vapore varia da liquido a liquido. A parità di temperatura è maggiore per i liquidi caratterizzati da deboli forze intermolecolari, per ciò detti volatili; è minore per i liquidi caratterizzati da intense forze intermolecolari che tengono particolarmente coese le particelle. Quando al crescere della temperatura la tensione di vapore eguaglia la pressione esterna (normalmente la pressione atmosferica), allora il processo di evaporazione interessa tutta la massa del liquido ed il passaggio di stato avviene in maniera tumultuosa, attraverso un processo detto di ebollizione. in cui si formano bolle di gas anche all’interno del liquido.

Si definisce punto di ebollizione normale la temperatura alla quale la tensione di vapore assume il valore di 760 mm di Hg (pressione normale). Per l’acqua, ad esempio, il punto di ebollizione normale è di 100°C(si noti come nel grafico seguente le curve della tensione di vapore crescano esponenzialmente al crescere della temperatura).
Naturalmente se la pressione esterna è inferiore a 760 mm, come avviene ad esempio in montagna, l’acqua raggiunge il punto di ebollizione a temperature inferiori; mentre se la pressione esterna è superiore, come in una pentola a pressione, l’acqua bolle a temperature superiori. Se forniamo calore ad un liquido esso aumenta la sua temperatura fino al momento in cui non raggiunge il suo punto di ebollizione. Durante il passaggio di stato la temperatura del liquido resta invece invariata nonostante l’apporto di calore. Il calore fornito non viene utilizzato per aumentare l’energia cinetica delle particelle, ma si trasforma in un aumento di energia potenziale delle particelle gassose. Tale calore, assorbito dal sistema senza produrre un aumento di temperatura, è noto come calore latente. Esso viene naturalmente restituito all’ambiente durante il processo di condensazione.

Tale comportamento è caratteristico di ogni passaggio di stato. Si noti che il passaggio dallo stato liquido a quello aeriforme è detto vaporizzazione e può avvenire per evaporazione, se la tensione di vapore è inferiore a quella atmosferica, o per ebollizione.
