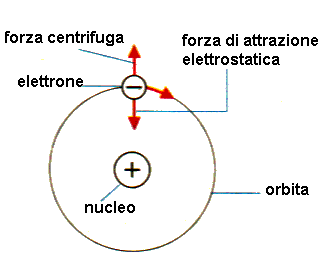
Modello atomico di Rutherford. Dopo che Rutherford si rese conto che l’atomo è vuoto (questo perché gli elettroni sono distanti dal nucleo) doveva riuscire a spiegare come mai protoni (dotati di carica elettrica positiva) ed elettroni (dotati di carica elettrica negativa), visto che erano dotati di cariche elettriche opposte, non risentissero delle forse elettrostatiche di attrazione e rimanessero distanti.
Modello atomico di Rutherford
Per spiegare il fatto che elettroni e protoni non risentissero delle forze di attrazione elettrostatiche, Rutherford ipotizzò che gli elettroni si muovessero intorno al nucleo secondo orbite circolari, in modo che la forza centrifuga bilanciasse esattamente in ogni istante la forza di attrazione elettrostatica.
In questa immagine possiamo vedere come l’elettrone risulta distante dal protone e con carica negativa opposta a quella positiva del protone; Rutherford per spiegare come gli elettroni potessero ruotare attorno al nucleo (in cui troviamo i protoni) senza essere attratti dagli stessi protoni, dotati di carica elettrica di segno opposto, avanzò la teoria che gli stessi elettroni ruotassero intorno al nucleo secondo orbite circolari, in modo tale che la forza centrifuga bilanciasse quella elettrostatica.
Quindi nel modello atomico di Rutherford: la forza centrifuga doveva bilanciare esattamente la forza di attrazione elettrostatica.